نشانگان منییر
| نشانگان منییر | |
|---|---|
 | |
| گوش داخلی | |
| تخصص | پزشکی گوش و حلق و بینی |
| فراوانی | 0.19% |
| طبقهبندی و منابع بیرونی | |
| آیسیدی-۱۰ | H81.0 |
| آیسیدی-۹-سیام | 386.0 |
| اُمیم | ۱۵۶۰۰۰ |
| دادگان بیماریها | 8003 |
| مدلاین پلاس | 000702 |
| ئیمدیسین | emerg/۳۰۸ |
| سمپ | D008575 |
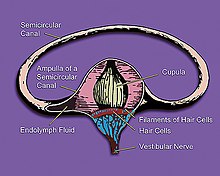
بیماری منییر (Ménière's disease; MD) یک اختلال در گوش داخلی است که با اپیزودهای بالقوه شدید و ناتوانکننده سرگیجه، وزوز گوش، کاهش شنوایی و احساس پری در گوش مشخص میشود [۱][۲]. بهطور معمول، در ابتدا فقط یک گوش تحت تاثیر قرار میگیرد، اما با گذشت زمان، هر دو گوش ممکن است درگیر شوند [۱]. اپیزودها معمولاً از 20 دقیقه تا چند ساعت طول میکشند [۳]. فاصله زمانی میان اپیزودها متفاوت است [۱]. کاهش شنوایی و شنیدن زنگ در گوش میتوانند به مرور زمان دائمی شوند[۲]. علت ایجاد بیماری منییر مشخص نیست، اما احتمالا ترکیبی از عوامل ژنتیکی و محیطی در ایجاد آن دخالت دارند[۴][۱]. چندین تئوری در مورد علت بروز آن مطرح هستند، از جمله انقباض عروق خونی، عفونتهای ویروسی، و واکنشهای خودایمنی[۱]. در حدود 10% موارد، ابتلا به بیماری به صورت خانوادگی (در بیش از یک عضو در خانواده) مشاهده میشود [۲]. اعتقاد بر این است که نشانهها در نتیجه تجمع مایع اضافی در لابیرنت (labyrinth) گوش داخلی رخ میدهند[۱]. تشخیص بیماری بر اساس نشانهها و تست شنوایی انجام میشود[۱]. دیگر شرایطی که ممکن است نشانههای مشابهی را ایجاد کنند، عبارتند از میگرن دهلیزی و حمله ایسکمیک گذرا [۴]. درمان قطعی برای این بیماری شناخته نشده است[۱]. حملات اغلب با داروهایی برای کنترل تهوع و اضطراب درمان میشوند[۲]. بهطور کلی، اقدامات پیشگیریکننده از بروز حملات چندان توسط شواهد پشتیبانی نمیشوند[۲]. رژیم غذایی کمنمک، دیورتیکها و کورتیکواستروئیدها ممکن است امتحان شوند[۲]. فیزیوتراپی میتواند به بهبود تعادل و مشاوره به کنترل اضطراب کمک کند [۱][۲]. در صورتی که دیگر اقدامات موثر نباشند، تزریق در گوش یا جراحی نیز ممکن است انجام شود، اما با خطراتی همراه هستند [۱][۳]. استفاده از لولههای تیمپانوستومی (tympanostomy) (لولههای ونتیلاسیون (ventilation tubes)) برای بهبود سرگیجه و شنوایی در افراد مبتلا به بیماری منییر توسط شواهد قطعی تایید نمیشوند[۳]. بیماری منییر در اوایل دهه 1800 توسط «پروسپر منییر» (Prosper Menière) شناخته شد[۳]. این بیماری بین 0.3 و 1.9 را در هر 1,000 نفر تحت تاثیر قرار میدهد[۴]. معمولا در افراد 40 تا 60 ساله شروع میشود [۱][۵]. زنان بیشتر از مردان مبتلا میشوند[۴]. پس از 5 تا 15 سال از شروع نشانهها، برخی مواقع اپیزودهای سرگیجه دَورانی متوقف شده و فرد با عدم تعادل، شنوایی ضعیف در گوش آسیبدیده، و صدای زنگ یا صداهای دیگر در گوش یا گوشهای مبتلا درگیر میماند[۳].
علائم و نشانهها
بیماری منییر با اپیزودهای مکرر سرگیجه، کاهش شنوایی نوسانی، و وزوز گوش مشخص میشود؛ ممکن است پیش از شروع اپیزودها، سردرد و احساس پُری در گوش وجود داشته باشد[۲]. افراد همچنین ممکن است دچار نشانههای دیگری شوند که مربوط به واکنشهای نامنظم سیستم عصبی خودمختار (اوتونوم) است. این نشانهها بهخودیخود علائم بیماری منییر نیستند، بلکه عوارض جانبی ناشی از اختلال در عملکرد اندام شنوایی و تعادل (گوش داخلی) بوده و شامل حالت تهوع، استفراغ و تعریق میشوند که بهطور معمول علائم سرگیجه هستند و نه بیماری منییر[۴]. این نشانهها همچنین شامل احساس هل داده شدن ناگهانی از پشت به زمین میشود[۳]. برخی افراد ممکن است دچار افتادن ناگهانی بدون از دست دادن هوشیاری (حملات سقوط) شوند[۴].
علل
علت ایجاد بیماری منییر نامشخص است، اما احتمالاً شامل عوامل ژنتیکی و محیطی میشود[۴][۱][۶]. چندین نظریه در مورد علت ایجاد آن وجود دارد، از جمله انقباض عروق خونی، عفونتهای ویروسی، و واکنشهای خودایمنی[۱].
مکانیسم
عوامل زمینهساز اولیه بیماری منییر بهطور کامل شناخته نشدهاند، برخی علل التهابی احتمالی باعث ایجاد هیدروپس اندولنفاتیک (endolymphatic hydrops; EH)، یعنی اتساع فضای اندولنف گوش داخلی، میشوند. هیدروپس اندولنفاتیک به شدت با ابتلا به بیماری منییر مرتبط است[۴]، اما همه افراد مبتلا به EH به بیماری منییر مبتلا نمیشوند: به عبارتی «ارتباط میان هیدروپس اندولنفاتیک و بیماری منییر یک همبستگی ساده و ایدهآل نیست»[۷].
علاوه بر این، در بیماری منییر کاملا پیشرفته، هر دو سیستم تعادلی (سیستم دهلیزی) و سیستم شنوایی (حلزون) گوش داخلی درگیر میشوند، اما در برخی موارد، EH فقط روی یکی از این دو سیستم تأثیر گذاشته و علائم را ایجاد میکند. زیرگروههای مربوط به این بیماری، بیماری منییر دهلیزی (با علائم سرگیجه) و بیماری منییر حلزونی (vestibular Ménière's disease) (با نشانههای کاهش شنوایی و وزوز گوش) نامیده میشوند[۸][۹][۱۰][۱۱].
مکانیسم ایجاد بیماری منییر بهطور کامل توسط EH توضیح داده نشده، با این حال، EH پیشرفته میتواند از نظر مکانیکی و شیمیایی در عملکرد سلولهای حسی تعادلی و شنوایی اخلال ایجاد کند، که ممکن است منجر به اختلال موقت در عملکرد و حتی مرگ سلولهای حسی شود که بهنوبهخود به نشانههای تیپیکال MD - سرگیجه، کاهش شنوایی، و وزوز گوش، میانجامد[۷][۹].
تخمین زده میشود که 30% از افراد مبتلا به بیماری منییر، دچار اختلال عملکرد شیپور اوستاش (Eustachian tube) هستند[۱۲].
تشخیص
سطوح ناراحتکننده بلندی صدا (loudness discomfort levels; LDLs) - دادههای افراد مبتلا بههایپراکوزیس (hyperacusis) بدون کاهش شنوایی. خط بالایی: متوسط حد آستانه (threshold) شنوایی. خط بلند پائین: LDLهای این گروه. خط کوتاه پائین: LDLهای یک گروه مرجع با شنوایی طبیعی[۱۳].
از سال 2015، معیارهای تشخیصی MD قطعی و MD احتمالی به صورت زیر تعریف میشود [۲][۴]:
قطعی:
دو یا چند اپیزود خودبهخودی از سرگیجه که هر کدام به مدت 20 دقیقه تا 12 ساعت طول بکشند. کاهش شنوایی حسی-عصبی در فرکانسهای پائین تا متوسط، ثبت شده با اودیومتری در گوش مبتلا، که حداقل در یک نوبت قبل، حین، یا پس از یکی از اپیزودهای سرگیجه رخ داده باشد. نشانههای نوسان شنوایی (شنوایی، وزوز، یا پُری) در گوش مبتلا قابل توضیح با تشخیص دیگری از اختلالات دهلیزی نباشد.
محتمل:
دو یا چند اپیزود خودبهخودی سرگیجه یا گیجی که هر کدام به مدت 20 دقیقه تا 24 ساعت طول بکشند. نشانههای نوسان شنوایی (شنوایی، وزوز، یا پُری) در گوش گزارششده قابل توضیح با تشخیص دیگری از اختلالات دهلیزی نباشد.
حساسیت مفرط به صداها، یک نشانه شایع و مهم MD است[۱۴]. این حساسیت مفرط به راحتی با اندازهگیری سطح ناراحتی بلندی صدا (LDL) تشخیص داده میشود[۱۵].
نشانههای MD تا حدود زیادی با سرگیجه مرتبط با میگرن (migraine-associated vertigo; MAV) همپوشانی دارند، اما در صورت بروز کاهش شنوایی در MAV، معمولاً در هر دو گوش رخ میدهد، در صورتی که این مورد در MD نادر بوده، و کاهش شنوایی بر خلاف MD معمولا در MAV پیشرفت نمیکند[۴].
افرادی که دچار حمله ایسکمیک گذرا (transient ischemic attack; TIA) یا سکته مغزی شدهاند، ممکن است علائمی شبیه به MD داشته باشند، و در افراد در معرض خطر، تصویربرداری رزونانس مغناطیسی (MRI) باید برای رد TIA یا سکته انجام شود[۴].
دیگر اختلالات دهلیزی که باید از تشخیص افتراقی خارج شوند، عبارتند از: پاروکسیسمی دهلیزی (vestibular paroxysmia)، وستیبولوپاتی عود کننده یک طرفه (recurrent unilateral vestibulopathy)، شوآنوم دهلیزی (vestibular schwannoma)، یا تومور کیسه اندولنفاتیک (endolymphatic sac tumor)[۴].
مدیریت بالینی
درمان قطعی برای بیماری منییر شناخته نشده، اما داروها، رژیم غذایی، فیزیوتراپی، و مشاوره، و برخی از روشهای جراحی میتوانند برای کنترل بیماری استفاده شوند[۲]. بیش از 85% از مبتلایان به بیماری منییر با تغییر سبک زندگی، درمان طبی یا پروسیجرهای جراحی کمتهاجمی، بهبود مییابند. این پروسیجرها شامل استروئید درمانی داخل تیمپان (intratympanic steroid therapy)، جنتامایسین داخل تیمپان (intratympanic gentamicin therapy) یا جراحی کیسه اندولنفاتیک (endolymphatic sac surgery) هستند[۱۶].
داروها
طی اپیزودهای MD، از داروهایی برای کاهش حالت تهوع، همچنین داروهایی برای کاهش اضطراب ناشی از سرگیجه استفاده میشود[۲][۱۷]. برای درمان طولانیمدتتر، به منظور جلوگیری از پیشرفت بیماری، پایه شواهد علمی برای همه درمانها ضعیف است[۲]. اگرچه رابطه علت و معلولی بین آلرژی و بیماری منییر نامشخص است، ممکن است داروهای کنترلکننده آلرژی مفید باشند[۱۸]. برای کمک به کنترل سرگیجه و مشکلات تعادل، گلیکوپیرولات (glycopyrrolate) به عنوان یک سرکوبکننده دهلیزی در بیماران مبتلا به بیماری منییر مفید شناخته شده است[۱۹].
دیورتیکها (داروهای ادرارآور)، مانند دیورتیک شبه-تیازید کلرتالیدون (chlortalidone)، برای مدیریت بالینی MD بهطور گستردهای استفاده میشوند، بر اساس این فرضیه که تجمع مایع (فشار) را در گوش کاهش میدهند[۲۰]. بر پایه شواهد حاصل از کارآزماییهای بالینی متعدد اما کوچک، به نظر میرسد که دیورتیکها برای کاهش وقوع دفعات اپیزودهای سرگیجه مفید باشند، اما به نظر نمیرسد که از کاهش شنوایی پیشگیری کنند[۲۱][۲۲].
در مواردی که کاهش شنوایی و اپیزودهای شدید مداوم سرگیجه رخ میدهند، ممکن است لابیرنتکتومی (labyrinthectomy) شیمیایی تجویز شود، که در این روش دارویی مانند جنتامایسین به گوش میانی تزریق میشود و بخشهایی از دستگاه دهلیزی را تخریب میکند[۲][۲۳][۲۴]. این روش درمانی با خطر تشدید کاهش شنوایی همراه است[۲۳].
رژیم غذایی
اغلب به افراد مبتلا به MD توصیه میشود که مصرف سدیم خود را کاهش دهند[۱۷][۲۵]. با این حال، تاثیر کاهش مصرف نمک به خوبی بررسی نشده است[۲۵]. برخی براساس این فرض که MD از نظر ماهیت شبیه به میگرن است، توصیه به حذف «عوامل محرک میگرن» مانند کافئین میکنند، اما شواهد برای این موضوع ضعیف است[۱۷]. شواهدی با کیفیت بالا وجود ندارد مبنی بر اینکه تغییر رژیم غذایی با محدود کردن نمک، کافئین یا الکل نشانهها را بهبود میبخشد[۲۶].
فیزیوتراپی
در حالی که استفاده از فیزیوتراپی در اوایل شروع MD به دلیل ماهیت نوسانی دوره بیماری احتمالا مفید نیست، به نظر میرسد که فیزیوتراپی برای کمک به بازآموزی سیستم تعادل در جهت کاهش نقایص ذهنی و عینی تعادل در طولانیمدت مفید باشد[۲][۲۷].
مشاوره
فشار روانی ناشی از سرگیجه و کاهش شنوایی ممکن است وضعیت را در برخی افراد بدتر کند[۲۸]. مشاوره برای مدیریت آشفتگی[۲]، همچنین آموزش و تکنیکهای آرامشبخشی میتوانند مفید باشند[۲۹].
عمل جراحی
درصورتی که نشانهها با رویکردهای کمتهاجمی بهبود نیابند و در مواردی که بیماری کنترل نشده یا مزمن شده و هر دو گوش را درگیر کند، ممکن است جراحی در نظر گرفته شود[۲][۱۷][۳۰].
جراحی کیسه اندولنفاتیک
جراحی برای رفع فشار کیسه اندولنفاتیک یکی از روشهای جراحی است که گاهی برای درمان این وضعیت پیشنهاد میشود. گاهی سه روش برای جراحی رفع فشار کیسه اندولنفاتیک پیشنهاد میشود: رفع فشار ساده، قرار دادن شانت یا برداشتن کیسه[۳۱]. برخی شواهد بسیار ضعیف وجود دارد که نشان میدهد هر سه روش ممکن است در کاهش سرگیجه مفید باشند، اما سطح شواهدی که از این پروسیجرهای جراحی پشتیبانی میکنند، پائین بوده و انجام تحقیقاتی با کیفیت بالاتر پیشنهاد شده است[۳۱]. یک خطر در این نوع پروسیجرهای جراحی، جابهجایی یا قرارگیری نامناسب شانتهای مورد استفاده در این جراحیها است[۱۷]. یک مرور سیستماتیک در سال 2014 گزارش داد که در افراد مبتلا به موارد شدید بیماری که واجد شرایط دریافت جراحی رفع فشار کیسه اندولنفاتیک هستند، این جراحی در کنترل سرگیجه در کوتاهمدت (بیش از 1 سال پیگیری) و طولانیمدت (بیش از 24 ماه) درحداقل 75% افراد مؤثر بود[۳۲].
لولههای ونتیلاسیون
کاشت لولههای اوستاش (لولههای ونتیلاسیون (ventilation tubes)) با کمک جراحی بهطور قوی توسط مطالعات پزشکی تایید نمیشود. شواهد غیرقطعی مبنی بر مزیت لولههای تیمپانوستومی (tympanostomy tubes) برای بهبود عدم تعادل ناشی از بیماری وجود دارد[۱۲]، و نتیجهگیری در مورد میزان موثر بودن این جراحی و احتمال عوارض جانبی و مضرات آن مشخص نیست[۶][۳۰].
دیگر مداخلات جراحی
جراحیهای تخریبی مانند لابیرنتکتومی عصب دهلیزی (vestibular nerve labyrinthectomy) غیرقابل برگشت بوده و شامل حذف کامل عملکرد بیشتر یا کل گوش درگیر میشود؛ از سال 2013، تقریباً هیچ شواهدی برای قضاوت در مورد مؤثر بودن این جراحیها وجود ندارد[۳۳]. کل گوش داخلی را نیز میتوان با جراحی از طریق لابیرنتکتومی (labyrinthectomy) برداشت، اگرچه همیشه با این عمل، قدرت شنوایی در گوش درگیر بهطور کامل از بین میرود[۳۳]. جراح همچنین میتواند عصب مربوط به بخش تعادلی گوش داخلی را به روش نورکتومی دهلیزی (vestibular neurectomy) قطع کند. با این روش، شنوایی اغلب تا حد زیادی حفظ میشود؛ با این حال، این جراحی شامل ایجاد برش در پوشش مغز میشود و نیاز به بستری چند روزه در بیمارستان برای پایش دارد[۳۳].
درمانهایی با شواهد ضعیف
از سال 2014، بتاهیستین (betahistine) به دلیل ارزان و بیخطر بودن اغلب استفاده میشود[۳]؛ اما شواهد موجود، استفاده از آن را برای بیماری منییر توجیه نمیکند[۳۴][۳۵].
پالسهای ریز-فشار ترانستیمپانیک (transtympanic micropressure pulses) در دو مرور سیستماتیک مورد بررسی قرار گرفتند. در هیچ یک از این بررسیها، شواهدی برای توجیه استفاده از این تکنیک یافت نشد[۳۶][۳۷].
تزریق استروئیدهای داخل تیمپان در سه مرور سیستماتیک مورد بررسی قرار گرفتند. دادهها برای تصمیمگیری در مورد تاثیرات مثبت این درمان ناکافی بودند[۳۸][۳۹][۴۰].
شواهد از استفاده از درمانهای جایگزین مانند طب سوزنی یا مکملهای گیاهی پشتیبانی نمیکند[۱].
پیشآگهی
بیماری منییر معمولاً از یک گوش شروع میشود و در حدود 30% موارد به هر دو گوش گسترش مییابد[۳]. ممکن است افراد در ابتدا فقط دچار یک نشانه باشند، اما هر سه نشانه به مرور زمان ظاهر میشوند[۳]. کاهش شنوایی در مراحل اولیه معمولا نوسان دارد و در مراحل بعدی دائمیتر میشود. دوره بیماری منییر 5 تا 15 سال است و افراد عموما در نهایت دچار عدم تعادل خفیف، وزوز گوش و کاهش شنوایی متوسط در یک گوش میشوند[۳]. از سال 2020، هیچ پیشرفت مهمی در زمینه پژوهش در پاتوژنز بیماری منییر حاصل نشده است[۴۱].
همهگیرشناسی (اپیدمیولوژی)
بین 3% و 11% از موارد سرگیجههای تشخیص داده شده در کلینیکهای نورو-اتولوژی (neuro-otological) ناشی از بیماری منییر است[۴۲]. نرخ بروز سالانه آن، حدود 15 مورد در هر 100,000 نفر تخمین زده میشود و میزان شیوع آن حدود 218 نفر در هر 100,000 نفر است و حدود 15% از افراد مبتلا به بیماری منییر، بالای 65 سال هستند[۴۲]. در حدود 9% موارد، یکی از بستگان بیمار نیز به بیماری منییر مبتلا بوده که نشاندهنده زمینه ژنتیکی در برخی موارد است[۲].
شانس ابتلا به بیماری منییر در افرادی با نژاد سفید، چاقی مفرط و زنان بیشتر است[۴]. چندین بیماری اغلب بهطور همزمان با بیماری منییر دیده میشوند، از جمله آرتریت، پسوریازیس، بیماری ریفلاکس معده به مری، سندرم روده تحریکپذیر و میگرن[۴].
تاریخچه
این بیماری به نام پزشک فرانسوی «پروسپر منییر» (Prosper Menière) نامگذاری شده است، که در مقالهای در سال 1861 نشانههای اصلی بیماری را شرح داد و نخستین کسی بود که یک اختلال واحد را برای توضیح تمام نشانهها، در اندام ترکیبی تعادل و شنوایی در گوش داخلی، پیشنهاد کرد[۴۳][۴۴].
آکادمی گوش و حلق و بینی آمریکا - کمیته جراحی سر و گردن پیرامون شنوایی و تعادل (American Academy of Otolaryngology – Head and Neck Surgery Committee on Hearing and Equilibrium) معیارهایی را برای تشخیص بیماری منییر تعیین کرده و همچنین دو زیرمجموعه را برای آن تعریف میکند: نوع حلزونی (بدون سرگیجه) و نوع دهلیزی (بدون ناشنوایی)[۴۵].
در سال 1972، آکادمی مذکور معیارهایی را برای تشخیص بیماری منییر به شرح زیر تعریف کرد[۴۵]:
ناشنوایی حسی-عصبی، پیشرونده، نوسانی
حملات دورهای، مشخص و قطعی سرگیجه با مدت 20 دقیقه تا 24 ساعت بدون از دست دادن هوشیاری، و نیستاگموس دهلیزی همیشه وجود دارد.
وزوز گوش (شنیدن زنگ در گوش، از خفیف تا شدید) اغلب با درد گوش و احساس پری در گوش درگیر همراه است. معمولاً وزوز گوش پیش از حمله سرگیجه شدیدتر است و پس از حمله سرگیجه کاهش مییابد.
حملات با دورههای بهبودی و وخامت مشخص میشوند.
در سال 1985، تغییراتی در نحوه بیان این فهرست صورت گرفت، مانند تغییر اصطلاح «ناشنوایی» به عبارت «کاهش شنوایی مرتبط با وزوز گوش، مشخصا در فرکانسهای پائین» و برای تشخیص بیماری نیاز به بیش از یک حمله سرگیجه در نظر گرفته شد[۴۵]. سرانجام در سال 1995، فهرست مجدداً اصلاح شد تا درجات مختلفی را برای بیماری در نظر بگیرد:
حتمی - بیماری قطعی با تأیید هیستوپاتولوژی
قطعی – نیاز به دو یا چند اپیزود قطعی سرگیجه همراه با کاهش شنوایی به علاوه وزوز گوش و/یا پری گوش دارد
محتمل - فقط یک اپیزود قطعی سرگیجه و دیگر علائم و نشانهها
ممکن - سرگیجه قطعی بدون کاهش شنوایی مرتبط
در سال 2015، کمیته بینالمللی طبقهبندی اختلالات دهلیزی انجمن بارانی (International Classification for Vestibular Disorders Committee of the Barany Society) با همکاری آکادمی آمریکایی گوش و حلق و بینی – جراحی سر و گردن (American Academy of Otolaryngology–Head and Neck Surgery)، آکادمی اروپایی اوتولوژی و نورواوتولوژی (European Academy of Otology and Neurootology)، انجمن تحقیقات تعادل ژاپن (Japan Society for Equilibrium Research) و انجمن تعادل کره (Korean Balance Society) معیارهای تشخیصی توافقی را منتشر کردند[۲][۴].
منابع
[ویرایش]- ↑ ۱٫۰۰ ۱٫۰۱ ۱٫۰۲ ۱٫۰۳ ۱٫۰۴ ۱٫۰۵ ۱٫۰۶ ۱٫۰۷ ۱٫۰۸ ۱٫۰۹ ۱٫۱۰ ۱٫۱۱ ۱٫۱۲ ۱٫۱۳ "Ménière's Disease". NIDCD. 1 June 2016. Archived from the original on 27 July 2016. Retrieved 18 July 2016.
- ↑ ۲٫۰۰ ۲٫۰۱ ۲٫۰۲ ۲٫۰۳ ۲٫۰۴ ۲٫۰۵ ۲٫۰۶ ۲٫۰۷ ۲٫۰۸ ۲٫۰۹ ۲٫۱۰ ۲٫۱۱ ۲٫۱۲ ۲٫۱۳ ۲٫۱۴ ۲٫۱۵ ۲٫۱۶ ۲٫۱۷ Seemungal B, Kaski D, Lopez-Escamez JA (August 2015). "Early Diagnosis and Management of Acute Vertigo from Vestibular Migraine and Ménière's Disease". Neurologic Clinics. 33 (3): 619–628, ix. doi:10.1016/j.ncl.2015.04.008. ISSN 1557-9875. PMID 26231275.
- ↑ ۳٫۰۰ ۳٫۰۱ ۳٫۰۲ ۳٫۰۳ ۳٫۰۴ ۳٫۰۵ ۳٫۰۶ ۳٫۰۷ ۳٫۰۸ ۳٫۰۹ Harcourt J, Barraclough K, Bronstein AM (2014). "Meniere's disease". BMJ (Clinical Research Ed.). 349: g6544. doi:10.1136/bmj.g6544. PMID 25391837. S2CID 5099437.
- ↑ ۴٫۰۰ ۴٫۰۱ ۴٫۰۲ ۴٫۰۳ ۴٫۰۴ ۴٫۰۵ ۴٫۰۶ ۴٫۰۷ ۴٫۰۸ ۴٫۰۹ ۴٫۱۰ ۴٫۱۱ ۴٫۱۲ ۴٫۱۳ ۴٫۱۴ Lopez-Escamez JA, Carey J, Chung WH, et al. (2015). "Diagnostic criteria for Menière's disease". Journal of Vestibular Research: Equilibrium & Orientation. 25 (1): 1–7. doi:10.3233/VES-150549. ISSN 1878-6464. PMID 25882471.
- ↑ Phillips JS, Westerberg B (6 July 2011). "Intratympanic steroids for Ménière's disease or syndrome". The Cochrane Database of Systematic Reviews (7): CD008514. doi:10.1002/14651858.CD008514.pub2. ISSN 1469-493X. PMID 21735432.
- ↑ ۶٫۰ ۶٫۱ Salt AN, Plontke SK (2010). "Endolymphatic hydrops: pathophysiology and experimental models". Otolaryngologic Clinics of North America. 43 (5): 971–983. doi:10.1016/j.otc.2010.05.007. PMC 2923478. PMID 20713237.
- ↑ ۷٫۰ ۷٫۱ "Ménière's Disease". Nidcd.nih.gov (Publication No. 10–3404) (June 1, 2016 ed.). US: National Institutes of Health. July 2010. Archived from the original on 27 July 2016.
- ↑ Gürkov R, Pyykö I, Zou J, Kentala E (2016). "What is Menière's disease? A contemporary re-evaluation of endolymphatic hydrops". Journal of Neurology. 263 (Suppl 1): 71–81. doi:10.1007/s00415-015-7930-1. PMC 4833790. PMID 27083887.
- ↑ ۹٫۰ ۹٫۱ Naganawa S, Nakashima T (2014). "Visualization of endolymphatic hydrops with MR imaging in patients with Ménière's disease and related pathologies: current status of its methods and clinical significance". Japanese Journal of Radiology. 32 (4): 191–204. doi:10.1007/s11604-014-0290-4. PMID 24500139.
- ↑ Mom T, Pavier Y, Giraudet F, Gilain L, Avan P (2015). "Measurement of endolymphatic pressure". European Annals of Otorhinolaryngology, Head and Neck Diseases. 132 (2): 81–84. doi:10.1016/j.anorl.2014.05.004. PMID 25467202.
- ↑ Walther LE (2005). "Procedures for restoring vestibular disorders". GMS Current Topics in Otorhinolaryngology, Head and Neck Surgery. 4: Doc05. PMC 3201005. PMID 22073053.
- ↑ ۱۲٫۰ ۱۲٫۱ Sheldrake J, Diehl PU, Schaette R (2015). "Audiometric characteristics of hyperacusis patients". Frontiers in Neurology. 6: 105. doi:10.3389/fneur.2015.00105. PMC 4432660. PMID 26029161.
- ↑ Chi JJ, Ruckenstein MJ (2010). "Chapter 6: Clinical Presentation of Ménière's disease". In Ruckenstein M (ed.). Ménière's disease: evidence and outcomes. San Diego, California Abingdon, England: Plural Publishing, Inc. p. 34. ISBN 978-1-59756-620-9.
- ↑ Tyler RS, Pienkowski M, Roncancio ER, et al. (2014). "A review of hyperacusis and future directions: part I. Definitions and manifestations" (PDF). American Journal of Audiology. 23 (4): 402–419. doi:10.1044/2014_AJA-14-0010. PMID 25104073. Archived from the original (PDF) on 27 June 2017. Retrieved 19 October 2017.
- ↑ Sajjadi H, Paparella MM (August 2008). "Meniere's disease". Lancet. 372 (9636): 406–414. doi:10.1016/S0140-6736(08)61161-7. PMID 18675691. S2CID 20845192. Archived from the original on 15 December 2022. Retrieved 15 December 2022.
- ↑ Foster CA (2015). "Optimal management of Ménière's disease". Therapeutics and Clinical Risk Management. 11: 301–307. doi:10.2147/TCRM.S59023. ISSN 1176-6336. PMC 4348125. PMID 25750534.
- ↑ ۱۷٫۰ ۱۷٫۱ ۱۷٫۲ ۱۷٫۳ ۱۷٫۴ Weinreich HM, Agrawal Y (June 2014). "The Link Between Allergy and Menière's Disease". Current Opinion in Otolaryngology & Head and Neck Surgery. 22 (3): 227–230. doi:10.1097/MOO.0000000000000041. ISSN 1068-9508. PMC 4549154. PMID 24573125.
- ↑ Storper IS, Spitzer JB, Scanlan M (1998). "Use of glycopyrrolate in the treatment of Meniere's disease". The Laryngoscope. 108 (10): 1442–1445. doi:10.1097/00005537-199810000-00004. PMID 9778280. S2CID 39137575.
- ↑ Thirlwall AS, Kundu S (19 July 2006). "Diuretics for Ménière's disease or syndrome". The Cochrane Database of Systematic Reviews. 2010 (3): CD003599. doi:10.1002/14651858.CD003599.pub2. ISSN 1469-493X. PMC 9007146. PMID 16856015.
- ↑ Crowson MG, Patki A, Tucci DL (May 2016). "A Systematic Review of Diuretics in the Medical Management of Ménière's Disease". Otolaryngology–Head and Neck Surgery. 154 (5): 824–834. doi:10.1177/0194599816630733. ISSN 1097-6817. PMID 26932948. S2CID 24741244.
- ↑ Stern Shavit S, Lalwani AK (2019). "Are diuretics useful in the treatment of meniere disease?". Laryngoscope. 129 (10): 2206–2207. doi:10.1002/lary.28040. PMID 31046134.
- ↑ Pullens B, van Benthem PP (16 March 2011). "Intratympanic gentamicin for Ménière's disease or syndrome". The Cochrane Database of Systematic Reviews (3): CD008234. doi:10.1002/14651858.CD008234.pub2. PMID 21412917.
- ↑ ۲۳٫۰ ۲۳٫۱ Huon LK, Fang TY, Wang PC (July 2012). "Outcomes of intratympanic gentamicin injection to treat Ménière's disease". Otology & Neurotology. 33 (5): 706–714. doi:10.1097/MAO.0b013e318259b3b1. PMID 22699980. S2CID 32209105.
- ↑ Espinosa-Sanchez JM, Lopez-Escamez JA (2016). "Menière's disease". Neuro-Otology. Handbook of Clinical Neurology. Vol. 137. pp. 257–277. doi:10.1016/B978-0-444-63437-5.00019-4. ISBN 978-0-444-63437-5. PMID 27638077.
- ↑ ۲۵٫۰ ۲۵٫۱ Hussain K, Murdin L, Schilder AG (31 December 2018). "Restriction of salt, caffeine and alcohol intake for the treatment of Ménière's disease or syndrome". Cochrane Database of Systematic Reviews. 2018 (12): CD012173. doi:10.1002/14651858.CD012173.pub2. ISSN 1469-493X. PMC 6516805. PMID 30596397.
- ↑ Clendaniel RA, Tucci DL (December 1997). "Vestibular rehabilitation strategies in Meniere's disease". Otolaryngologic Clinics of North America. 30 (6): 1145–1158. doi:10.1016/S0030-6665(20)30155-9. ISSN 0030-6665. PMID 9386249.
- ↑ Orji F (2014). "The Influence of Psychological Factors in Meniere's Disease". Annals of Medical and Health Sciences Research. 4 (1): 3–7. doi:10.4103/2141-9248.126601 (inactive 24 April 2024). ISSN 2141-9248. PMC 3952292. PMID 24669323.
- ↑ Greenberg SL, Nedzelski JM (October 2010). "Medical and noninvasive therapy for Meniere's disease". Otolaryngologic Clinics of North America. 43 (5): 1081–1090. doi:10.1016/j.otc.2010.05.005. ISSN 1557-8259. PMID 20713246.
- ↑ Lee A, Webster KE, George B, Harrington-Benton NA, Judd O, Kaski D, Maarsingh OR, MacKeith S, Ray J, Van Vugt VA, Burton MJ (24 February 2023). Cochrane ENT Group (ed.). "Surgical interventions for Ménière's disease". Cochrane Database of Systematic Reviews. 2023 (2): CD015249. doi:10.1002/14651858.CD015249.pub2. PMC 9955726. PMID 36825750.
- ↑ ۳۰٫۰ ۳۰٫۱ Lim MY, Zhang M, Yuen HW, et al. (November 2015). "Current evidence for endolymphatic sac surgery in the treatment of Meniere's disease: a systematic review". Singapore Medical Journal. 56 (11): 593–598. doi:10.11622/smedj.2015166. ISSN 0037-5675. PMC 4656865. PMID 26668402.
- ↑ ۳۱٫۰ ۳۱٫۱ Sood AJ, Lambert PR, Nguyen SA, et al. (July 2014). "Endolymphatic sac surgery for Ménière's disease: a systematic review and meta-analysis". Otology & Neurotology. 35 (6): 1033–1045. doi:10.1097/MAO.0000000000000324. ISSN 1537-4505. PMID 24751747. S2CID 31381271.
- ↑ Pullens B, Verschuur HP, van Benthem PP (2013). "Surgery for Ménière's disease". The Cochrane Database of Systematic Reviews. 2013 (2): CD005395. doi:10.1002/14651858.CD005395.pub3. ISSN 1469-493X. PMC 7389445. PMID 23450562.
- ↑ ۳۳٫۰ ۳۳٫۱ ۳۳٫۲ James AL, Burton MJ (2001). "Betahistine for Menière's disease or syndrome". The Cochrane Database of Systematic Reviews. 2020 (1): CD001873. doi:10.1002/14651858.CD001873. ISSN 1469-493X. PMC 6769057. PMID 11279734.
- ↑ Adrion C, Fischer CS, Wagner J, et al. (2016). "Efficacy and safety of betahistine treatment in patients with Meniere's disease: Primary results of a long term, multicentre, double blind, randomised, placebo controlled, dose defining trial (BEMED trial)". BMJ. 352: h6816. doi:10.1136/bmj.h6816. PMC 4721211. PMID 26797774.
- ↑ van Sonsbeek S, Pullens B, van Benthem PP (2015). "Positive pressure therapy for Ménière's disease or syndrome". Cochrane Database Syst Rev. 2015 (3): CD008419. doi:10.1002/14651858.CD008419.pub2. PMC 11026870. PMID 25756795.
- ↑ Syed MI, Rutka JA, Hendry J, et al. (2015). "Positive pressure therapy for Meniere's syndrome/disease with a Meniett device: A systematic review of randomised controlled trials". Clinical Otolaryngology. 40 (3): 197–207. doi:10.1111/coa.12344. PMID 25346252. S2CID 1025535.
- ↑ Hu A, Parnes LS (2009). "Intratympanic steroids for inner ear disorders: A review". Audiology and Neurotology. 14 (6): 373–382. doi:10.1159/000241894. PMID 19923807. S2CID 38726308.
- ↑ Miller MW, Agrawal Y (2014). "Intratympanic Therapies for Menière's disease". Current Otorhinolaryngology Reports. 2 (3): 137–143. doi:10.1007/s40136-014-0055-8. PMC 4157672. PMID 25215266.
- ↑ Liu Y, Yang J, Duan M (October 2020). "Current status on researches of Meniere's disease: a review". Acta Otolaryngol. 140 (10): 808–812. doi:10.1080/00016489.2020.1776385. PMID 32564698. S2CID 219972013.
- ↑ Iwasaki S, Yamasoba T (February 2015). "Dizziness and Imbalance in the Elderly: Age-related Decline in the Vestibular System". Aging and Disease. 6 (1): 38–47. doi:10.14336/AD.2014.0128. ISSN 2152-5250. PMC 4306472. PMID 25657851.
- ↑ Ishiyama G, et al. (April 2015). "Meniere's disease: histopathology, cytochemistry, and imaging". Ann N Y Acad Sci. 1343 (1): 49–57. Bibcode:2015NYASA1343...49I. doi:10.1111/nyas.12699. PMID 25766597. S2CID 36495592.
- ↑ ۴۲٫۰ ۴۲٫۱ Ménière P (1861). "Sur une forme de surdité grave dépendant d'une lésion de l'oreille interne" [On a form of severe deafness dependent on a lesion of the inner ear]. Bulletin de l'Académie Impériale de Médecine (in French). 26. republished online at gallica.bnf.fr: 241. Archived from the original on 16 February 2016.
- ↑ Beasley NJ, Jones NS (December 1996). "Menière's disease: evolution of a definition". J Laryngol Otol. 110 (12): 1107–1113. doi:10.1017/S002221510013590X. PMID 9015421. S2CID 37842353.
- ↑ Ménière P (1861). "Sur une forme de surdité grave dépendant d'une lésion de l'oreille interne" [On a form of severe deafness dependent on a lesion of the inner ear]. Bulletin de l'Académie Impériale de Médecine (in French). 26. republished online at gallica.bnf.fr: 241. Archived from the original on 16 February 2016.
- ↑ ۴۵٫۰ ۴۵٫۱ ۴۵٫۲ Beasley NJ, Jones NS (December 1996). "Menière's disease: evolution of a definition". J Laryngol Otol. 110 (12): 1107–1113. doi:10.1017/S002221510013590X. PMID 9015421. S2CID 37842353.
- دورلند فرهنگ پزشکی. تهران
